Los hongos productores de psilocibina, comúnmente conocidos como «hongos mágicos», han sido utilizados durante siglos en diversas sociedades por sus propiedades curativas consideradas sagradas.
Pero en las últimas décadas, el interés médico sobre estos organismos ha resurgido debido a la acumulación de evidencia sobre su potencial terapéutico en el tratamiento de diversas enfermedades.
A pesar de este creciente interés, la investigación científica se ha centrado predominantemente en la psilocibina y su metabolito activo psilocina, descuidando la riqueza de otros metabolitos secundarios que estos hongos producen.
Un reciente estudio publicado en Scientific Reports por Cohen et al. aborda esta brecha mediante un análisis integral de 42 cepas de hongos con psilocibina pertenecientes a 9 especies distintas, revelando una diversidad metabolómica significativa y estableciendo metodologías estandarizadas para su estudio.
Contenido
Metodología de extracción
El estudio comenzó abordando uno de los mayores desafíos en la investigación de hongos psilocibínicos que es la falta de estandarización en los métodos de extracción.
Los investigadores seleccionaron tres especies representativas denominadas Psilocybe cubensis BG, Panaeolus cyanescens Vietnam y Psilocybe tampanensis TampG, para optimizar los parámetros de extracción que afectan directamente el perfil metabolómico final.
Evaluaron sistemáticamente tres variables críticas, el tiempo de extracción, la relación tejido/solvente y la polaridad del solvente.
Luego, utilizando cromatografía líquida de alta eficacia (HPLC-DAD), analizaron la concentración de los principales metabolitos indolaminas que son psilocibina, psilocina y baeocistina.
Los resultados mostraron que los metabolitos principales se extraen eficientemente en tan solo 30 minutos, con una tendencia a disminuir la eficiencia de extracción entre 6 y 24 horas.
En cuanto a la relación tejido/solvente, encontraron que una proporción de 1:20 es suficiente para extraer indolaminas de una amplia variedad de hongos, sin necesidad de volúmenes mayores.
En cuanto al solvente, se observó que la psilocibina y la psilocina se disuelven mejor en una mezcla de 25% agua y 75% metanol (H₂O:MeOH), mientras que la baeocistina se obtiene en mayores cantidades con metanol puro, posiblemente porque en este solvente se degrada menos por desfosforilación.
Además, descubrieron que ajustar el pH del agua a 9 mediante acetato de amonio aumentó significativamente la eficiencia de extracción de todos los metabolitos en Psilocybe cubensis BG, aunque los efectos variaron entre especies.
Para validar la eficiencia de la extracción, los investigadores sometieron el mismo tejido a dos extracciones adicionales bajo condiciones idénticas.
La segunda extracción produjo solo entre 10 y 12% de psilocibina y menos del 10% de psilocina y baeocistina en comparación con la extracción inicial, mientras que la tercera extracción produjo menos del 5% para todos los metabolitos.
Estos resultados confirmaron que menos del 10% de los metabolitos permanecieron en el tejido después de la primera extracción, lo que descarta la necesidad de extracciones repetidas.
El enfoque final optimizado consistió en una extracción con una relación de 1:20 (tejido:solvente) usando una mezcla de agua y metanol en proporción 25:75 (H₂O:MeOH) ajustada a pH 9, durante 1,5 horas.
Este procedimiento produjo un polvo liofilizado homogéneo y estable que resultó ser cuatro veces más concentrado que la biomasa original, adecuado para análisis reproducibles in vitro e in vivo.
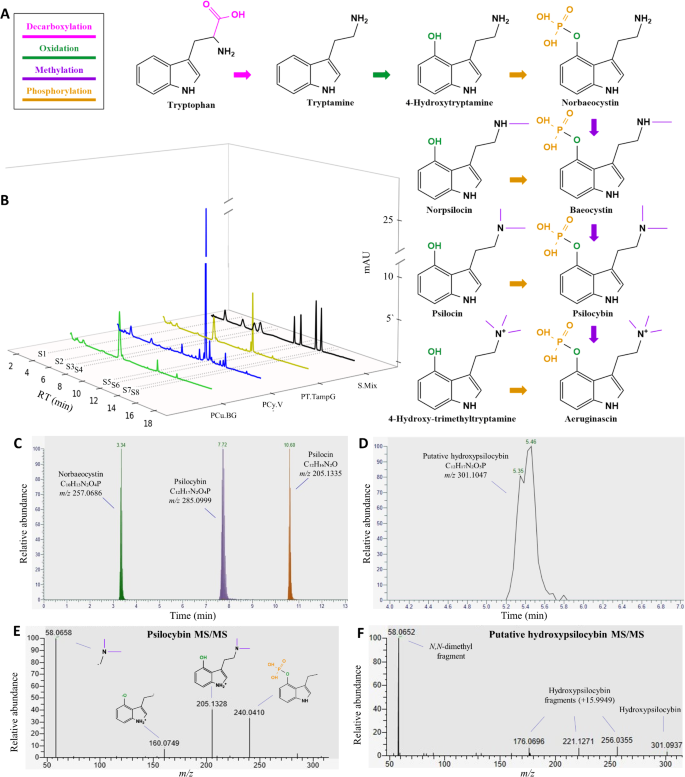
Identificación y cuantificación de metabolitos
Una vez establecida la metodología de extracción, los investigadores abordaron la identificación y cuantificación precisa de los metabolitos.
El camino biosintético conocido, que se origina en el aminoácido triptófano y conduce a las indolaminas derivadas de triptófano, incluye cuatro procesos de transformación, es decir, descarboxilación, oxidación, metilación y fosforilación, orquestados en los hongos por las enzimas PsiD, PsiH, PsiM y PsiK, respectivamente.
Los metabolitos identificados consistentemente en diferentes concentraciones en todos los hongos psilocibínicos incluyeron triptófano, triptamina, norbaeocistina, norpsilocina, baeocistina, psilocina, psilocibina y aeruginascina.
Los metabolitos de los hongos psilocibina tienen estructuras muy parecidas, lo que hace difícil distinguirlos con técnicas como HPLC-DAD, ya que sus señales se superponen.
Para resolverlo, los investigadores usaron una columna cromatográfica especial que logró separar adecuadamente estos compuestos, pudiendo identificar y cuantificar con precisión ocho metabolitos clave, como la psilocibina y la psilocina, usando estándares conocidos.
Sin embargo, para descubrir compuestos nuevos, necesitaron una técnica más avanzada llamada espectrometría de masas (HPLC-MS/MS).
Gracias a ella, encontraron una molécula nunca antes reportada en la cepa Psilocybe cubensis «Golden Teacher», a la que llamaron putativamente hidroxipsilocibina.
Esta sustancia es muy parecida a la psilocibina, pero con un átomo de oxígeno extra, lo que se confirmó por su masa molecular y el patrón de fragmentación.
Aunque ya se sabe que existe, aún no se conoce exactamente dónde está ubicado el oxígeno adicional en su estructura.
Agrupamiento de metabolitos secundarios
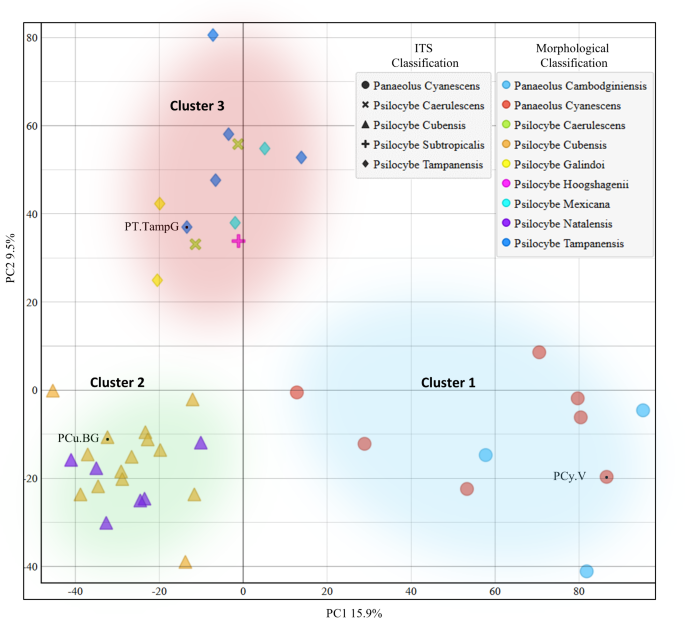
Tras establecer las metodologías óptimas de extracción e identificación, los investigadores seleccionaron la mayor diversidad de cepas posible de 9 especies distintas, extrayendo un total de 42 cepas de hongos con psilocibina según la identificación morfológica.
Debido a que la precisión taxonómica de la determinación de especies según la identificación morfológica puede ser poco confiable, todas las 42 muestras fueron también referenciadas con identificación del espaciador transcrito interno (ITS).
Los metabolomas fúngicos se analizaron con HPLC-MS/MS y se utilizó el análisis de componentes principales (PCA) no supervisado para investigar las similitudes metabolómicas entre las diferentes cepas.
El PCA reveló que los dos primeros componentes principales explicaban el 25.4% (PC1 15.9%, PC2 9.5%) de la varianza. La agrupación metabólica se correlacionó mejor con la identificación ITS que con la clásica morfológica.
Según la identificación ribosomal ITS, cubensis y natalensis se identificaron ambos como cubensis, mientras que mexicana, galindoi y tampanensis se identificaron como tampanensis.
Las especies de Panaeolus formaron un grupo distinto en comparación con el grupo principal de las especies de Psilocybe (como indica PC1 en el eje x).
Dentro del género Psilocybe, cubensis se agrupó por separado de las otras especies de Psilocybe (como indica PC2 en el eje y).
Este análisis visualizado demostró claramente que los hongos con psiocibina no pueden ser tratados como un grupo cohesivo, sino que cada cepa posee un metaboloma único con potencial farmacéutico distintivo.
Por ejemplo, Psilocybe cubensis BG exhibió el contenido más alto de psilocibina, mientras que Panaeolus cyanescens Vietnam tuvo los niveles más altos de psilocina.
Psilocybe tampanensis TampG mostró cantidades iguales de ambos compuestos. El cromatograma UV indicó que las dos especies de Psilocybe compartían más similitudes entre sí que con la especie de Panaeolus, que contenía mayores cantidades de metabolitos menores y numerosos picos no identificados.
Método dedesfosforilación In Vitro
Un proceso principal al ingerir cuerpos fructíferos de hongos con psilocibina es la desfosforilación de la psilocibina por la fosfatasa alcalina y otras esterasas no específicas en el tracto gastrointestinal y el hígado.
Aunque esta desfosforilación ocurre en entornos experimentales in vivo en los que se administran extractos fúngicos por vía oral, la mayoría de los sistemas in vitro carecen de esta complejidad y la psilocibina no se transforma en psilocina.
Para simular el proceso que ocurre en el cuerpo cuando se ingieren hongos psilocibínicos, los investigadores desarrollaron un método in vitro que convierte la psilocibina en psilocina, un paso clave en su activación.
Utilizaron una enzima purificada llamada fosfatasa alcalina (AP), que elimina el grupo fosfato de la psilocibina. Determinaron que la velocidad de esta reacción es de 60 nanogramos de psilocibina por minuto por unidad de enzima (60 ng/min/U), lo que permite una conversión rápida y completa.
Validaron el método usando un extracto de Psilocybe cubensis BG. Inicialmente, el extracto contenía 2.8% de psilocibina y 0.7% de psilocina.
Después de aplicar la desfosforilación in vitro, la psilocibina casi desapareció (por debajo del límite de detección), mientras que la psilocina aumentó hasta un 3.5%.
Este método permite estudiar en el laboratorio el efecto real de los hongos después de ser metabolizados, mejorando la precisión de los estudios in vitro.
Diversidad metabolómica y potencial farmacéutico
El estudio de Cohen et al. revela de manera concluyente que los hongos psilocibínicos presentan una amplia gama de cepas diversas que albergan una riqueza de metabolitos secundarios con potencial bioactividad.
Sin embargo, los esfuerzos de investigación actuales se centran principalmente en la psilocibina y la psilocina, lo que lleva a la idea errónea de que estos hongos son un grupo uniforme que produce compuestos bioactivos similares.
Al analizar los metabolomas de 42 cepas de hongos distintas, el estudio demostró el metaboloma único de cada cepa, resaltando la diversidad química que podría ofrecer valiosas perspectivas para futuros esfuerzos farmacéuticos.
Este estudio sienta las bases para futuras investigaciones que exploren el potencial terapéutico de los diversos metabolitos presentes en los hongos psilocibínicos, más allá de la psilocibina.
La metodología estandarizada desarrollada permite comparaciones precisas entre diferentes cepas y especies, facilitando la identificación de perfiles metabolómicos específicos asociados con efectos biológicos particulares.
Además, el método de desfosforilación in vitro representa una herramienta valiosa para estudios preclínicos que buscan comprender los mecanismos de acción de estos compuestos en sistemas celulares.
A medida que avanza la investigación en este campo, es esencial reconocer y aprovechar la diversidad química inherente a estos organismos, lo que podría conducir al descubrimiento de nuevos compuestos terapéuticos con perfiles de actividad únicos y potencialmente mejorados.
Referencias
Cohen, J., Sulimani, L., Procaccia, S., Lerenthal, Y., Milay, L., Taran, I., Shapira, A., & Meiri, D. (2025). Comprehensive analysis of 42 psilocybin-producing fungal strains reveals metabolite diversity and species-specific clusters. Scientific Reports, 15, 13822. https://doi.org/10.1038/s41598-025-97710-z








